HUBUNGAN KONFIGURASI ELEKTRON DENGAN LETAK UNSUR DALAM TABEL PERIODIK (SPU)
Tabel Periodik (Sistem Periodik Unsur) sangat erat hubungannya dengan konfigurasi elektron. Bagaimana hubungannya ? Lihat gambar tabel berikut.
Dari tabel di atas terlihat bahwa antara Konfigurasi Eelektron dan letak suatu unsur dalam Sistem Periodik Unsur mempunyai hubungan yang erat. Dengan adanya hubungan ini kita dapat menentukan letak suatu unsur dalam Sistem Periodik Unsur tanpa melihat Sistem Periodik Unsur tersebut. Bagaimana caranya? Caranya adalah dengan :
- menuliskan konfigurasi elektron persubkulitnya lebih dahulu
- kemudian memperhatikan pengisian elektron terakhir di nomor kulit berapa dan subkulit apa berakhir.
- menghitung jumlah elektron pada subkulit terakhir
Catatan :
- nomor kulit, yaitu angka di depan subkulit ini mmenunjukkan PERIODE.
- subkulit menunjukkan apakah unsur tersebut golongan A atau golongan B.
- jika elektron berakhir pada subkulit s atau p berarti golongan A.
- jika elektron berakhir pada subkulit d berarti golongan B
- jika elektron berakhir pada subkult f berarti deret lantanida (4f) dan aktinida. (5f)
- jumlah elektron (jumlah angka pangkat pada subklit terakhir) menunjukkan golongan.
Keempat contoh unsur ini (H, Na, Mg dan Sr) pengisian elektron berakhir pada subkulit s berarti keempat unsur adalah golongan A (golongan utama).
Dua unsur pertama (H dan Na) jumlah elektron terluarnya (jumlah angka pangkat subkulit s ) adalah 1, berarti golongan I.
Dua unsur kedua (Mg dan Sr) jumlah elektron terluarnya (jumlah angka pangkat subkulit s ) adalah 2, berarti golongan II.
Nomor kulit subkulit terakhir untuk H adalah 1, berarti periode 1; untuk Na dan Mg adalah 3, berarti periode 3; dan untuk Sr adalah 5, berarti periode 5.
Kesimpulannya :
Keempat unsur ini dalam Sistem Periodik Unsur masing-masing :
Unsur H terletak pada golongan IA periode 1;
Unsur Na terletak pada golongan IA periode 3;
Unsur Mg terletak pada golongan IIA periode 3;
Unsur Sr terletak pada golongan IIA periode 5.
Secara umum untuk unsur yang pengisian elektronnya berakhir pada subkulit s, rumus penentuan golongan dan periodenya dapat ditulis :
Keterangan rumus : n adalah nomor kulit untuk menentukan perode, dan a jumlah elektron terluar.
2) Penggalan Tabel 1 bagian 2 (tiga unsur kedua : Al, Cl dan Ga)Ketiga unsur ini (Al, Cl dan Ga), pengisian elektron berakhir pada subkulit p berarti ketiga unsur juga adalah golongan A (golongan utama). Akan tetapi jumlah elektron terluarnya ditentukan oleh jumlah elektron subkulit s dan subkulit p (jumlah angka pangkat dari subkulit s dan subkulit p).
Unsur Al, jumlah elektron terluarnya (jumlah pangkat s dan p) adalah 2+1 = 3, berarti golongan III;
Unsur Cl, jumlah elektron terluarnya (jumlah pangkat s dan p) adalah 2+5 = 5, berarti golongan VII;
Unsur Ga, jumlah elektron terluarnya (jumlah pangkat s dan p) adalah 2+1 = 3, berarti golongan III.
Nomor kulit subkulit terakhir untuk Al dan Cl adalah 3, berarti periode 3; dan untuk Ga 4, berarti periode 4.
Kesimpulannya :
Dalam Sistem Periodik Unsur (SPU) masing-masing unsur :
Unsur Al terletak pada golongan IIIA periode 3;
Untuk Cl terletak pada golongan VIIA periode 3;
Untuk Ga terletak pada golongan IIIA periode 4.
Secara umum untuk unsur yang pengisian elektronnya berakhir pada subkulit p, rumus penentuan golongan dan periodenya adalah :
Keterangan rumus : n adalah nomor kulit untuk menentukan periode, a adalah jumlah elektron pada subkulit s dan b adalah jumlah elektron pada subkulit p (jumlah a+b menunjukkan golongan).
3) Penggalan Tabel 1 bagian 3 (Sc, Mn, Pd dan Au)
Keempat contoh unsur ini (Sc, Mn, Pd dan Au), pengisian elektronnya berakhir pada subkulit d , berarti keempat unsur tersebut adalah golongan B. Untuk menentukan golongannya adalah dengan melihat jumlah elektron pada subkulit s dan subkulit d.
Catatan untuk golongan B :
a) Jika jumlah elektron terluar suatu unsur = 8 atau 9 atau 10 maka unsur tersebut termasuk golongan VIII.
b) Jika jumlah elektron terlua suatu unsur = 11 berarti golongan I.
c) Jika jumlah elektron terluar suatu unsur = 12 berarti glongan II.
d) Untuk menentukan periode adalah dengan melihat nomor kulit terbesar (nomor kulit subkulit s).
Unsur Sc, jumlah elektron terluarnya (jumlah pangkat subkulit s dan subkulit d) adalah 2+1 = 3, berarti golongan III dan nomor kulit terbesarnya adalah 4, berarti periode 4:
Unsur Mn, jumlah elektron terluarnya (jumlah pangkat subkulit s dan subkulit d) adalah 2 + 5 = 7, berarti golongan VII dan nomor kulit terbesarnya adalah 4, berarti periode 4;
Unsur Pd, jumlah elektron terluarnya (jumlah pangkat subkulit s dan subkulit d) adalah 2 + 8 = 10, berarti golongan VIII ( bukan golongan X ) dan nomor kulit terbesarnya adalah 5, berart periode 5.
Unsur Au, jumlah elektron terluarnya (jumlah pangkat subkulit s dan subkulit d) adalah 2+9 = 11, berarti golongan I dan nomor kulit terbesarnya adalah 6, berarti periode 6.
Kesimpulan :
Dalam Sistem Periodik Unsur (SPU) :
Unsur Sc terletak pada golongan IIIB periode 4;
Unsur Mn terletak pada golongan VIIB periode 4;
Unsur Pd terletak pada golongan VIIIB periode 5;
Unsur Au terletak pada golongan IB periode 6.
Secara umum untuk unsur yang pengisian elektronnya berakhir pada subkulit d, rumus penentuan golongan dan periodenya dapat dinyatakan :
Keterangan : hurup n berwarna merah untuk menentukan periode.
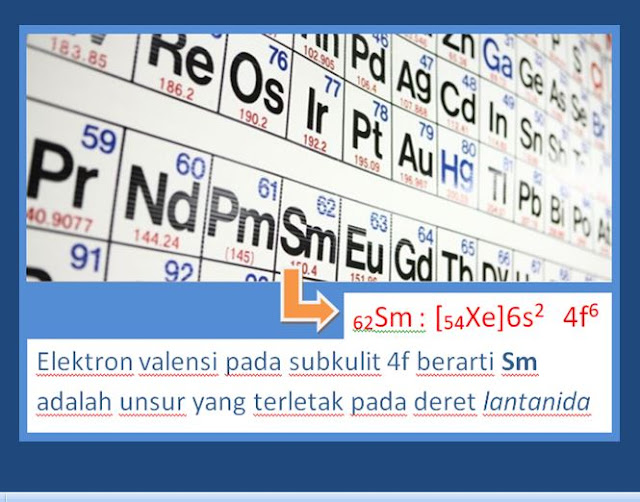
4) Penggalan Tabel 1 Bagian 4 (Sm dan U)
Kedua unsur Sm dan U, pengisian elektronnya berakhir pada subkulit f berarti keduanya termasuk golongan transisi dalam .
Jika pengisian elektron berakhir pada subkulit 4f berarti termasuk deret LANTANIDA;
Jika pengisian elektron berakhir pada subkulit 5f berarti termasuk deret AKTINIDA.
Demikian pembahasan mengenai hubungan konfigurasi elektron dengan SPU.
Semoga bermanfaat dan apa yang diharapkanpada pembelajaran ini bisa dicapai.
Posted by Mahmuddin











Tidak ada komentar:
Posting Komentar