STRUKTUR ATOM
1. Teori Atom / Model Atom
Untuk memahami hakikat ATOM dan STRUKTUR-nya, maka perlu dipelajari lebih dahulu tentang
Teori Atom dan Model Atom. Untuk mempelajari silakan simak tayangan video berikut :
Berdasarkan teori-teori yang disampaikan oleh para ahli ditayangan video di atas bahwa ATOM
adalah bagian terkecil dari suatu unsur yang masih memiliki sifat unsur tersebut.
Sedangkan unsur merupakan zat tunggal yang tidak dapat diuraikan lagi menjadi lain yang
lebih sederhana melalui reaksi kimia biasa.
Contoh Unsur
2. Partikel Dasar Penyusun Atom
Atom suatu unsur tersusun atas 3 partikel dasar, yaitu :
Proton dan neutron berada pada inti atom, sedang elektron berada disekitar inti atom. Jika
digambarkan akan tampak seperti gambar model atom Bohr berikut.
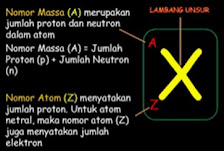
3. Nomor Atom (Z) dan Nomor Massa (A)
Nomor Atom adalah bilangan yang menunjukkan jumlah proton(p) dalam inti atom. Simbolnya : Z
Jika atomnya netral (tidak bermuatan), Nomor Atom juga menunjukkan jumlah elektron (e).
Nomor Massa atau Massa Atom adalah bilangan yang menunjukkan jumlah proton dan neutron(p+n) dalam inti atom. Simbolnya : A.
Jadi : A = p+n
Dan lambang atom/lambang unsur secara lengkap disimbolkan seperti gambar berikut.
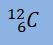
Artinya atom karbon (C) memiliki :
Nomor massa (A) = 12
Nomor Atom (Z) = 6
Jumlah proton (p) = Jumlah electron (e) = Z = 6
Jumlah neutron (n) = A – p = 12 – 6 = 6
Contoh : 2
Artinya atom aluminium (Al) memiliki :
Nomor massa (A) = 27
Nomor Atom (Z) = 13
Jumlah proton (p) = Jumlah electron (e) = Z = 13
Jumlah neutron (n) = A – p = 27 – 13 = 14
4. Isotop, Isobar dan Isoton
Isotop adalah atom-atom yang memiliki nomor atom sama tetapi nomor massa beda.
Contoh :
Isobar adalah atom-atom yang memiliki nomor atom beda tetapi nomor massa sama.
Contoh :
Contoh :
Untuk mempermudah ingatan, perhatikan gambar berikut.








Tidak ada komentar:
Posting Komentar